浙江大学医学院附属第二医院麻醉科严敏教授团队联合杭州师范大学车先伟副教授团队在疼痛领域顶尖期刊PAIN发表最新研究成果。
本课题研究延长的持续性θ节律经颅磁刺激(prolonged continuous theta burst stimulation, pcTBS)的阿片肽镇痛机制。该研究为一项随机、双盲、假刺激对照研究,通过静脉注射阿片受体的拮抗剂纳洛酮揭示内源性阿片系统是否参与运动皮层(primary motor cortex, M1)和背外侧前额叶(dorsal lateral prefrontal cortex, DLPFC)刺激诱导的镇痛作用。
结果显示:纳洛酮可逆转M1-pcTBS和DLPFC-pcTBS诱导的镇痛作用。然而,在纳洛酮代谢完成后只有M1靶点镇痛作用恢复。与M1相比,DLPFC靶点需进行两次pcTBS才能产生显著的镇痛作用。此外,M1-pcTBS和DLPFC-pcTBS分别选择性地增加了血浆中β-内啡肽或脑啡肽的浓度。通过严格的‘抑制-再激活’范式,该研究证实内源性阿片系统参与M1和DLPFC诱导的镇痛作用,并且在不同靶点存在剂量依赖作用。以下为详细介绍。

01 实验背景
· 重复性经颅磁刺激(rTMS)作用于初级运动皮层(M1)和左背外侧前额叶皮层(DLPFC)分别能有效缓解慢性神经病理性疼痛和偏头痛,其镇痛作用广受关注,但作用机制尚不明确。因此,明确rTMS的镇痛机制是优化其临床效应的重要方向。
·内源性阿片肽可以抑制伤害性感受信号的传递,然而只有个别研究探索了内源性阿片系统参与rTMS镇痛的机制,并报告了不一致的结果。已有的三项研究在刺激剂量上有显著差异。另一方面,早期研究仅针对阿片肽受体进行‘抑制’处理,没有采用更严格的‘抑制-再激活’研究范式。该范式能够为药物或干预研究提供更强的因果证据。
02 实验设计
针对以上两个问题,本研究设计了一个两阶段实验。我们首先探索静脉注射纳洛酮是否可逆转M1-rTMS和DLPFC-rTMS的镇痛作用,待纳洛酮代谢完成后再进行第二次rTMS刺激来恢复rTMS的镇痛作用。TMS刺激由M-100 Ultimate完成(英智科技)。
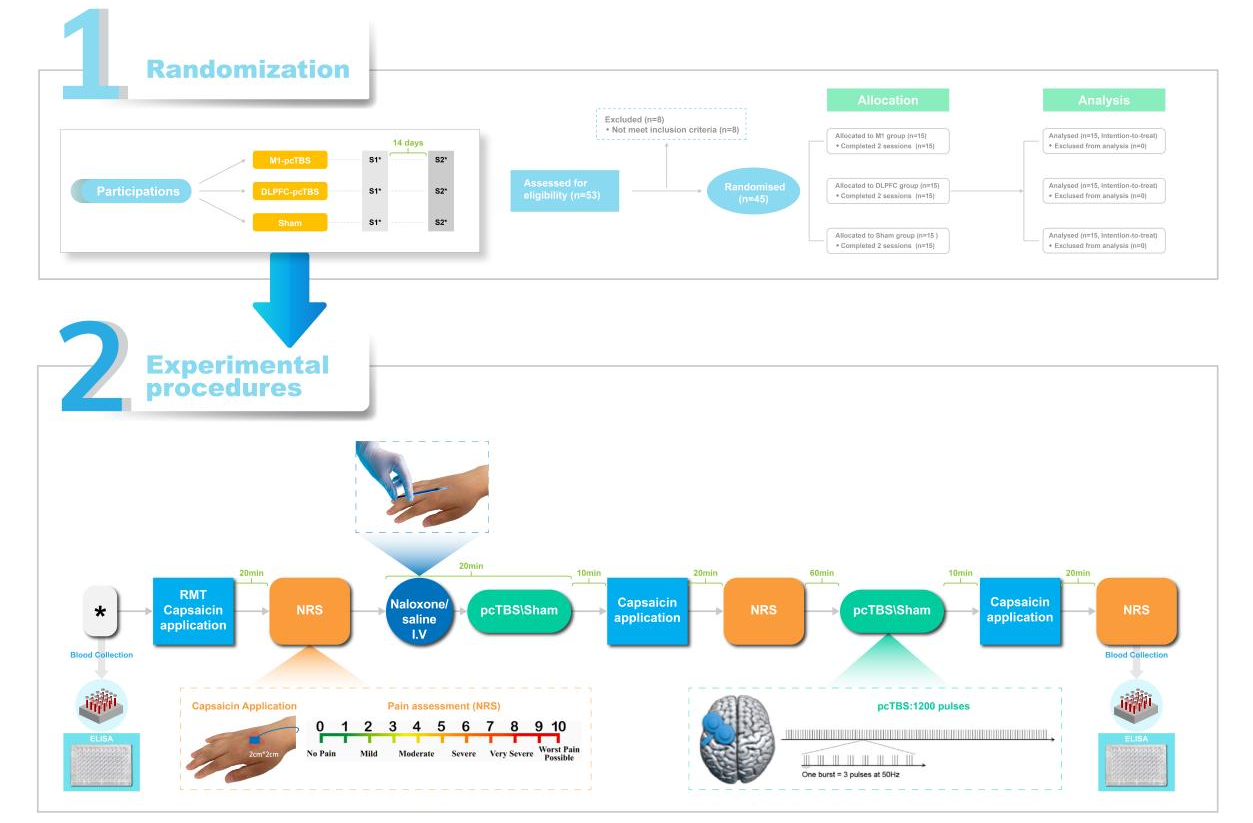
共计纳入45名受试者并随机分为三组(M1、DLPFC、Sham)。志愿者到访实验室两次(间隔≥2周),其中一次缓慢静脉注射纳洛酮,另一次注射同等剂量生理盐水。研究者在试验开始前(基线),第一次pcTBS干预后30分钟(Post1)、第二次pcTBS干预后30分钟(Post2)对志愿者的疼痛和血液指标进行评估。
03 实验结果
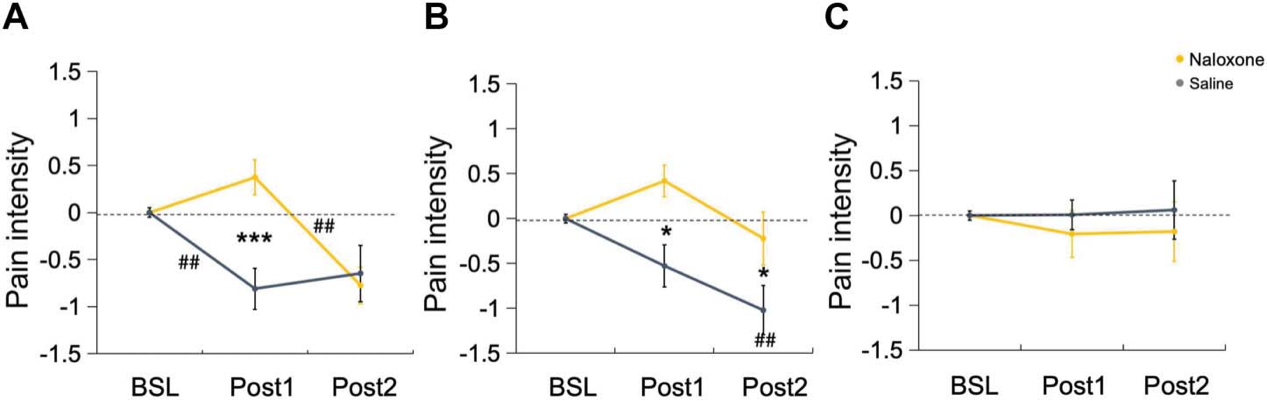
1.研究结果表明,第一次M1-pcTBS干预(Post1)降低了生理盐水条件下的疼痛强度,而两次pcTBS(Post2)并没有产生更强的镇痛效应。在纳洛酮条件下,第一次M1-pcTBS干预后疼痛强度不变,待纳洛酮代谢后(Post2),M1-pcTBS显著减轻疼痛强度。另外,纳洛酮Post1疼痛强度显著高于生理盐水。对于DLPFC靶点,两次DLPFC-pcTBS干预(Post2)才能降低生理盐水条件下的疼痛强度。在纳洛酮条件下,第一次 DLPFC-pcTBS干预后疼痛强度不变,而纳洛酮代谢后(Post2),第二次DLPFC-pcTBS仍然未能显著减轻疼痛,但纳洛酮条件Post1和Post2疼痛强度均显著高于生理盐水。Sham组各条件下均未见显著差异。
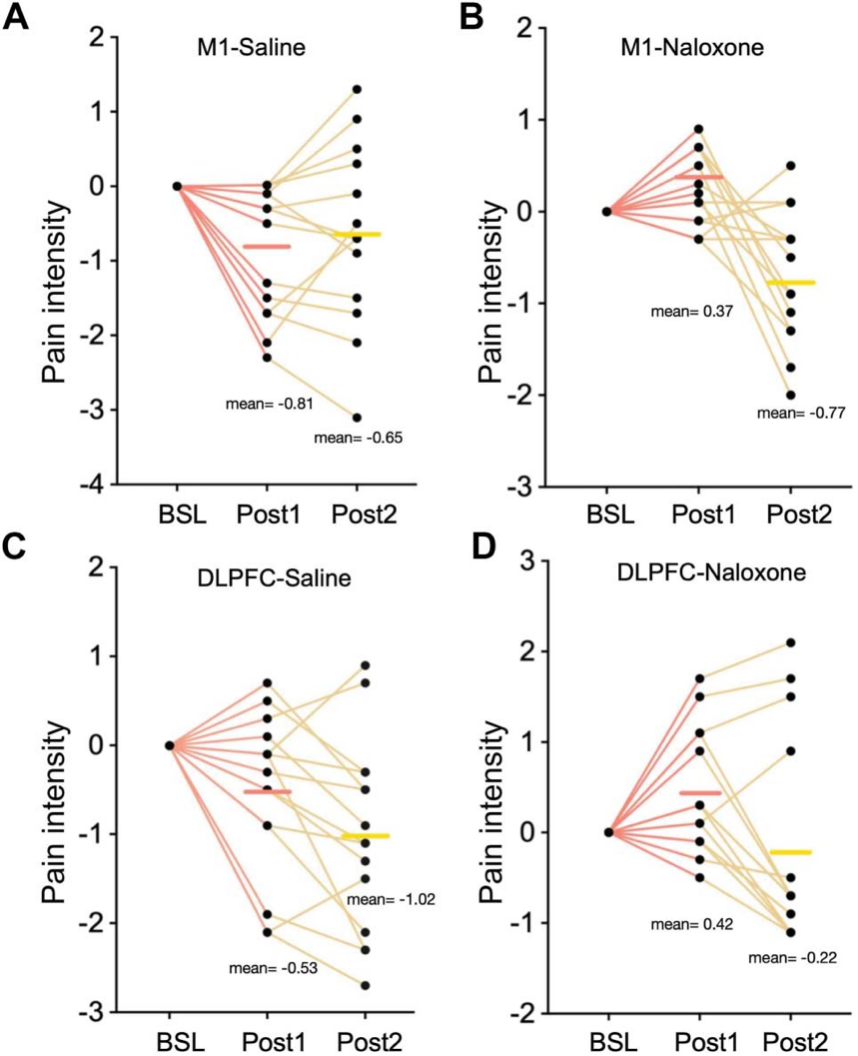
2.M1和DLPFC组生理盐水和纳洛酮条件下疼痛变化的个体数据如下图所示。两次DLPFC刺激可产生叠加的镇痛作用,而单次M1刺激即可以有效抑制疼痛。
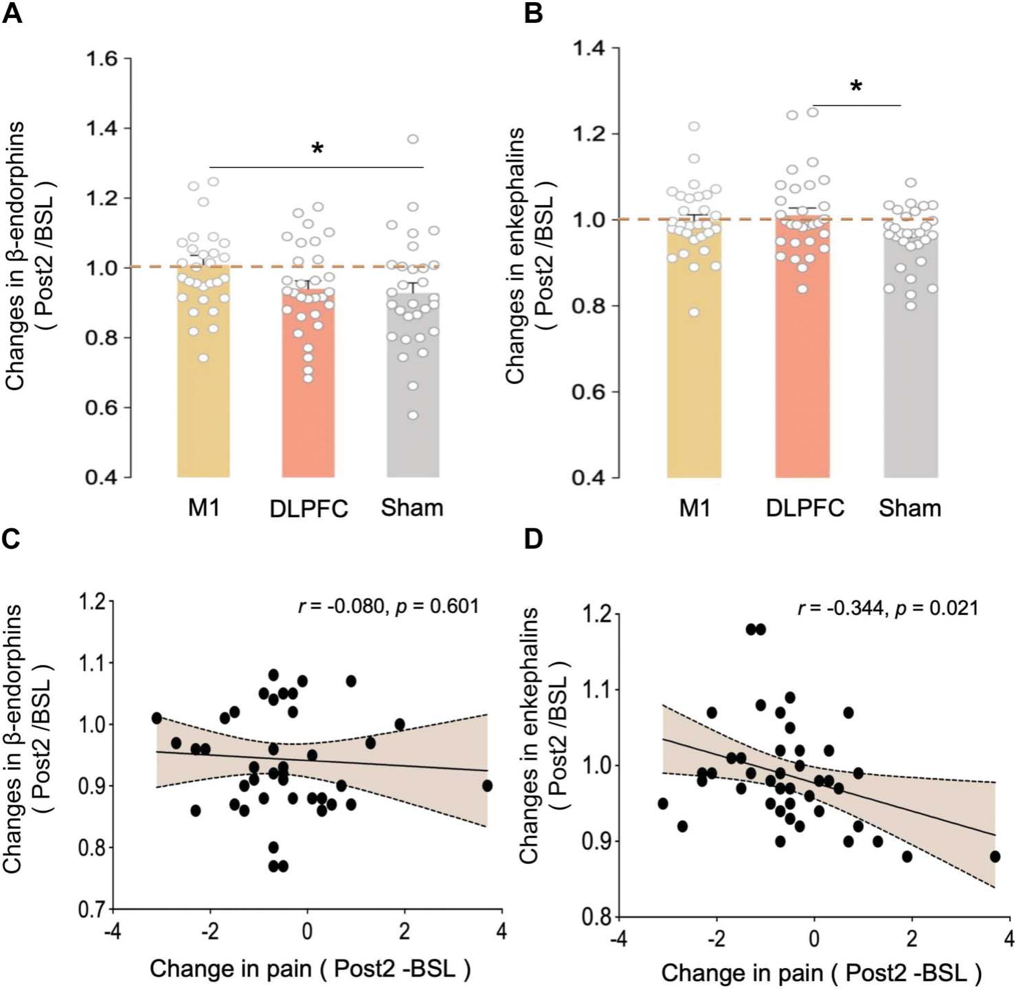
3.血浆中β内啡肽和脑啡肽数据显示,与Sham组相比,M1刺激可显著增加β内啡肽水平,而DLPFC刺激则可显著增加脑啡肽水平。相关分析表明,pcTBS干预后脑啡肽的变化与疼痛强度的变化存在共变关系。
04 实验结论
综上所述,本研究提供了内源性阿片系统参与M1和DLPFC-rTMS的镇痛作用的因果证据,并进一步证明了这种内源性阿片肽机制在不同靶点存在剂量依赖作用。
浙大二院严敏教授为本文通讯作者,杭州师范大学车先伟副教授为共同指导老师。浙大二院麻醉科刘颖博士和孙军锋老师为共同第一作者。本研究还得到了澳大利亚国立大学Paul Fitzgerald教授、Bernadette Fitzgibbon教授,和墨尔本大学Robin Cash教授的支持。该研究由国家自然科学基金(82071227)、国家临床重点专业建设项目(2021-LCZDZK-01)、浙江省重点研发计划(2022C03038)和浙江省自然科学基金(LY23C090002)资助完成。
课题负责人近期研究成果:
Wang Y, Tan B, Shi S, Ye Y, Che X. Dopamine D2 receptor antagonist modulates rTMS-induced pain experiences and corticospinal excitability dependent on stimulation targets. Int J Clin Health Psychol. 2024;24(1):100413. doi:10.1016/j.ijchp.2023.100413
Zhao H, Jiang C, Zhao M, et al. Comparisons of Accelerated Continuous and Intermittent Theta Burst Stimulation for Treatment-Resistant Depression and Suicidal Ideation. Biol Psychiatry. Published online December 22, 2023. doi:10.1016/j.biopsych.2023.12.013
Cheng M, Che X, Ye Y, et al. Analgesic efficacy of theta-burst stimulation for postoperative pain. Clin Neurophysiol. 2023;149:81-87. doi:10.1016/j.clinph.2023.02.174.
相关推荐: