2025年1月,电子科技大学段旭君教授团队在国际知名期刊《Biological Psychiatry》上发表了一项突破性研究成果,题为“Personalized theta-burst stimulation enhances social skills in young minimally verbal children with autism: a double-blind randomized controlled trial”。该研究基于个性化脑影像分析技术,采用连续theta爆发刺激(continuous theta burst stimulation, cTBS)方案,针对孤独症儿童的杏仁核及其神经环路进行精准干预,取得了显著的疗效。

一、论文概要
本研究通过双盲随机对照试验,探讨了个性化连续theta爆发刺激(cTBS)对语言功能障碍的孤独症儿童社交技能的改善效果。研究纳入44名2-8岁的自闭症儿童,分为基于杏仁核功能连接优化(amygdala-optimized functional connectivity,AOFC)的个性化刺激组和标准前额叶刺激的非优化(non-optimized,NO)对照组。结果显示,AOFC组在自闭症诊断观察量表(Autism Diagnostic Observation Schedule,ADOS)的社交和沟通评分上显著改善,且杏仁核体积、自发电活动及功能连接显著变化,这些变化与临床改善相关。研究证明个性化cTBS可通过调节杏仁核的结构和功能连接改善自闭症核心症状,为开发针对这一特殊群体的精准治疗策略提供了重要依据。
为验证这些假设,研究团队设计了一种个性化的基于杏仁核功能连接优化(AOFC)的 cTBS 策略,以刺激与杏仁核具有最强连接的前额叶皮层区域。通过采用随机、双盲、对照设计,研究了该 AOFC 指导的 cTBS 方案在低语言能力的ASD儿童中的效果。研究结果表明,个性化的 AOFC 指导 的cTBS 方案在缓解 ASD 核心症状方面具有显著效果,并揭示了治疗反应的神经生物学机制,证明了杏仁核的结构、活动和连接的可塑性促进了临床改善。团队的研究为发展针对性的、个性化的治疗策略提供了一条有前景的途径,尤其是针对语言能力极低的 ASD 儿童。
共招募了58名自闭症儿童(2-8岁、DSM-5临床诊断为ASD的幼儿),8例因不符合ADOS标准而被排除。最终,44名完成基线MRI的参与者被随机分配到AOFC组(n=23)和NO组(n=21)。在AOFC组中,23例完成治疗,22例完成治疗后ADOS和行为量表评估,18例完成治疗后MRI检查。在NO组中,19例完成治疗,17例完成治疗后ADOS评估,15例完成行为量表评估,15例完成治疗后MRI检查。两组基线阶段人口统计学和ADOS评分(除了重复刻板行为,RRB)是相匹配的。

四、方法
实验设计
采用双盲随机对照试验(DB-RCT),参与者被随机分为两组:AOFC组,接受个性化的杏仁核连接引导的cTBS刺激;非优化(NO)对照组,接受EEG F3部位的刺激。随机化由未参与治疗的研究人员进行。基线通过进行自闭症诊断观察量表(ADOS)评估、家长行为量表评分和MRI扫描。两组均接受cTBS治疗,疗程20天(4周,每周5个工作日)。治疗结束后3天内进行治疗后评估。
cTBS方案
使用了脉冲磁场刺激仪(M-100Ultimate,深圳英智科技有限公司,中国深圳)和8字形线圈施加cTBS 刺激。刺激靶点通过TMS导航系统(Quiks Vision,深圳英智科技有限公司,中国深圳)确定,并标记在泳帽上。每次 cTBS 刺激由3个50 Hz的脉冲串组成,每200毫秒重复一次,总共 600个脉冲。每天进行三次治疗(每天共计 1800 个脉冲),每次持续 40.04 秒,两次治疗分别间隔 10 分钟和 20 分钟。刺激强度设置为静息运动阈值的 90%。
盲法程序
参与者、临床评估员和治疗提供者对治疗任务一无所知。参与者被随机分配到AOFC或NO组,使用相同的刺激线圈和靶标记。NO组在靶向和刺激方面与AOFC组的程序相同,使参与者无法区分他们属于哪一组。参与者的护理人员被指示不要与工作人员或其他参与者讨论他们的治疗分配,以确保双盲设计。
MRI数据采集与分析
MRI 扫描使用了 3T GE扫描仪和8通道头部线圈进行。采集了高分辨率的T1加权图像和静息态功能性MRI(fMRI)图像。每次静息态 fMRI 扫描的持续时间为5分钟10秒,共155个时间点。为了确保数据质量和参与者的舒适性,MRI扫描是在轻度镇静的情况下进行的。结构性 MRI 分析使用了 FreeSurfer 软件进行处理,治疗后的杏仁核灰质体积变化通过配对 t 检验和 Cohen's d 进行评估,两组之间的体积变化率通过独立t检验进行比较。静息态 fMRI 分析使用了 DPARSF 软件进行,杏仁核在静息态下的低频波动幅度(ALFF)变化通过配对 t 检验和 Cohen's d 进行评估;评估了杏仁核种子区域与整个大脑的功能连接变化,并进行平均连接变化的组间比较;计算了杏仁核与内在网络之间的功能连接强度(FCS)。此外,在每个组内还研究了 ADOS 总分减少率与 FCS 变化之间的相关性。
连接引导的个性化刺激
对于 AOFC 组,个性化的杏仁核连接引导靶点是通过基线 MRI 扫描生成的。这个过程包括了手动共定位、fMRI 预处理、个体 T1 分割、杏仁核和左侧背侧前额叶皮层区域的定义,并计算杏仁核与前额叶皮层之间的功能连接性,以识别与杏仁核最相关的体素作为个性化刺激靶点。
电场建模以比较非优化组的最佳标准刺激靶点
研究了NO组治疗反应与前额叶皮层刺激位置之间的关系。根据每个受试者治疗前杏仁核功能连接图,对每个受试者的最佳刺激目标进行回顾性计算。计算了 F3 刺激靶点与杏仁核之间的功能连接强度,以及 F3 刺激靶点与最优靶点之间的欧氏距离,并将其与 ADOS 总分减少率进行了相关分析。对于最优刺激靶点和 F3 靶点的电场进行建模,分析电场热点重叠与 ADOS 总分减少率之间的相关性。
五、研究结果
通过ADOS评估cTBS治疗效果(图1)
在 AOFC 组中,观察到总分及沟通与社交互动分数有显著下降,表明cTBS 治疗能有效减轻 ASD的临床症状。统计数据如下:
总分:t = 3.06, p = 0.005, pFDR = 0.029, Cohen’s d = 0.55
沟通与社交互动分数:t = -2.51, p = 0.02, pFDR = 0.05, Cohen’s d = 0.56
在 NO 组(未优化组),没有观察到总分或沟通与社交互动分数的显著变化,表明 NO 组没有出现明显的改善。具体统计结果如下:
总分:t = -1.79, p = 0.09(未校正), pFDR = 0.153, Cohen’s d = 0.24
沟通与社交互动分数:t = -2.16, p = 0.046(未校正), pFDR = 0.115, Cohen’s d = 0.40
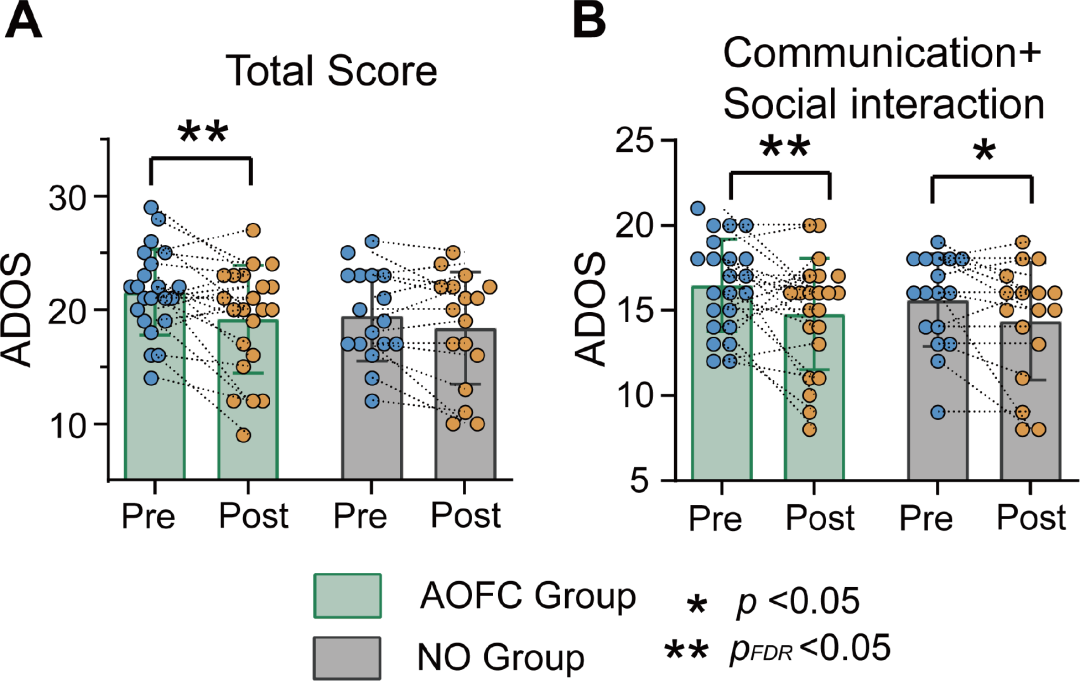
图1.cTBS诱导AOFC组和NO组治疗前后(A)ADOS总分和(B)ADOS沟通+社交互动评分的变化。
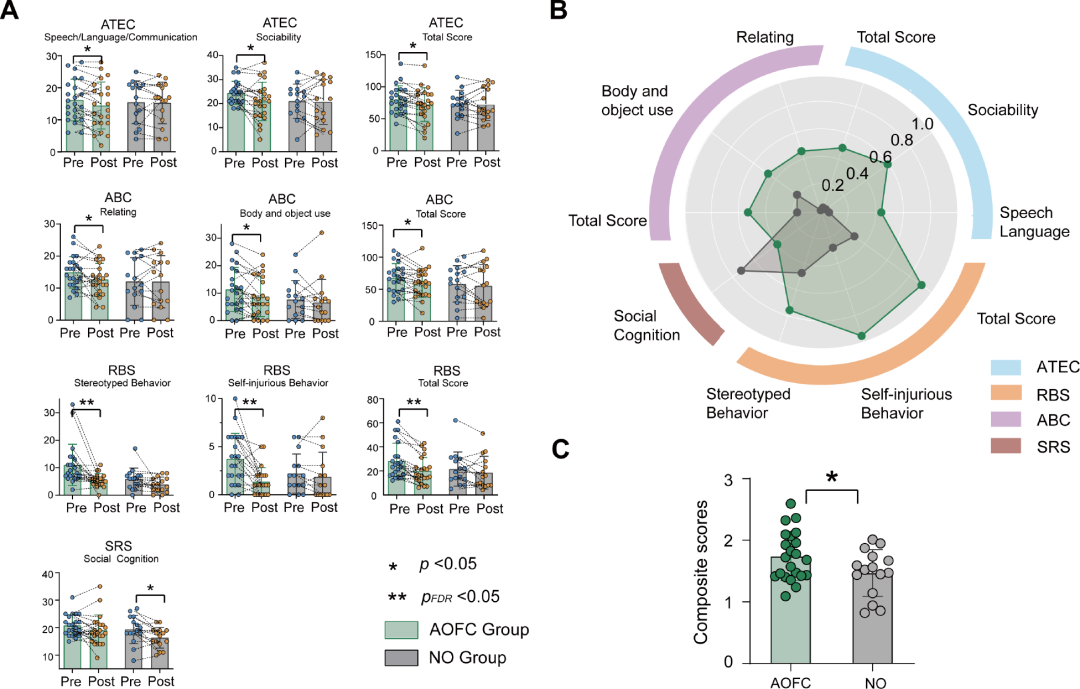
图2.(A)cTBS诱导AOFC和NO组自闭症结果指标的变化.(B) 十项结果指标的cTBS治疗效应大小(Cohen’d).(C) A组中显示的所有子评分的综合评分显示.
神经活动变化
使用ALFF静息状态fMRI数据评估了cTBS治疗后杏仁核的局部功能变化。AOFC组右侧杏仁核ALFF显著降低(t=-2.671,p=0.016,Cohen’s d=0.85)(图3C)。NO组右侧杏仁核没有变化(t=-1.189,p=0.254,Cohen’s d =0.39)。AOFC组和No组的左杏仁核均未发现显著变化。这些结果表明,AOFC组的cTBS治疗导致右杏仁核自发神经活动显著减少,而No组没有观察到这种变化。
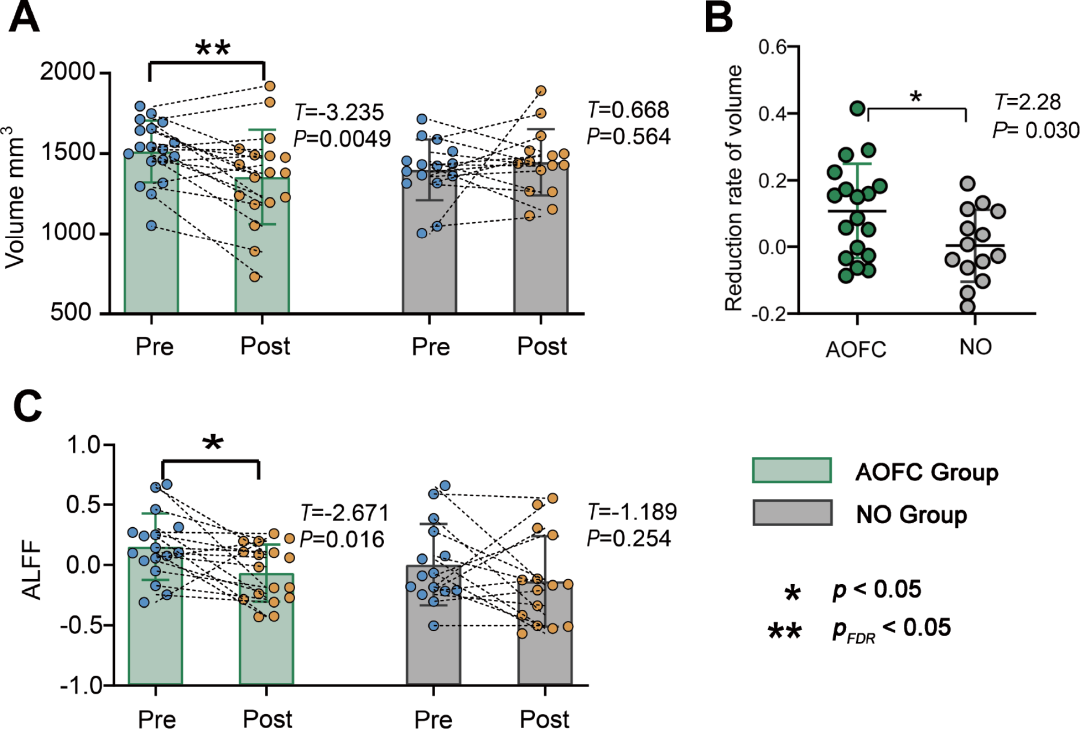
图3.(A)cTBS诱导AOFC和NO组右杏仁核灰质体积的变化.(B) AOFC组与NO组的右杏仁核灰质体积减少率的组间分析(C)评估AOFC组和NO组在治疗前后右侧杏仁核自发神经活动的变化
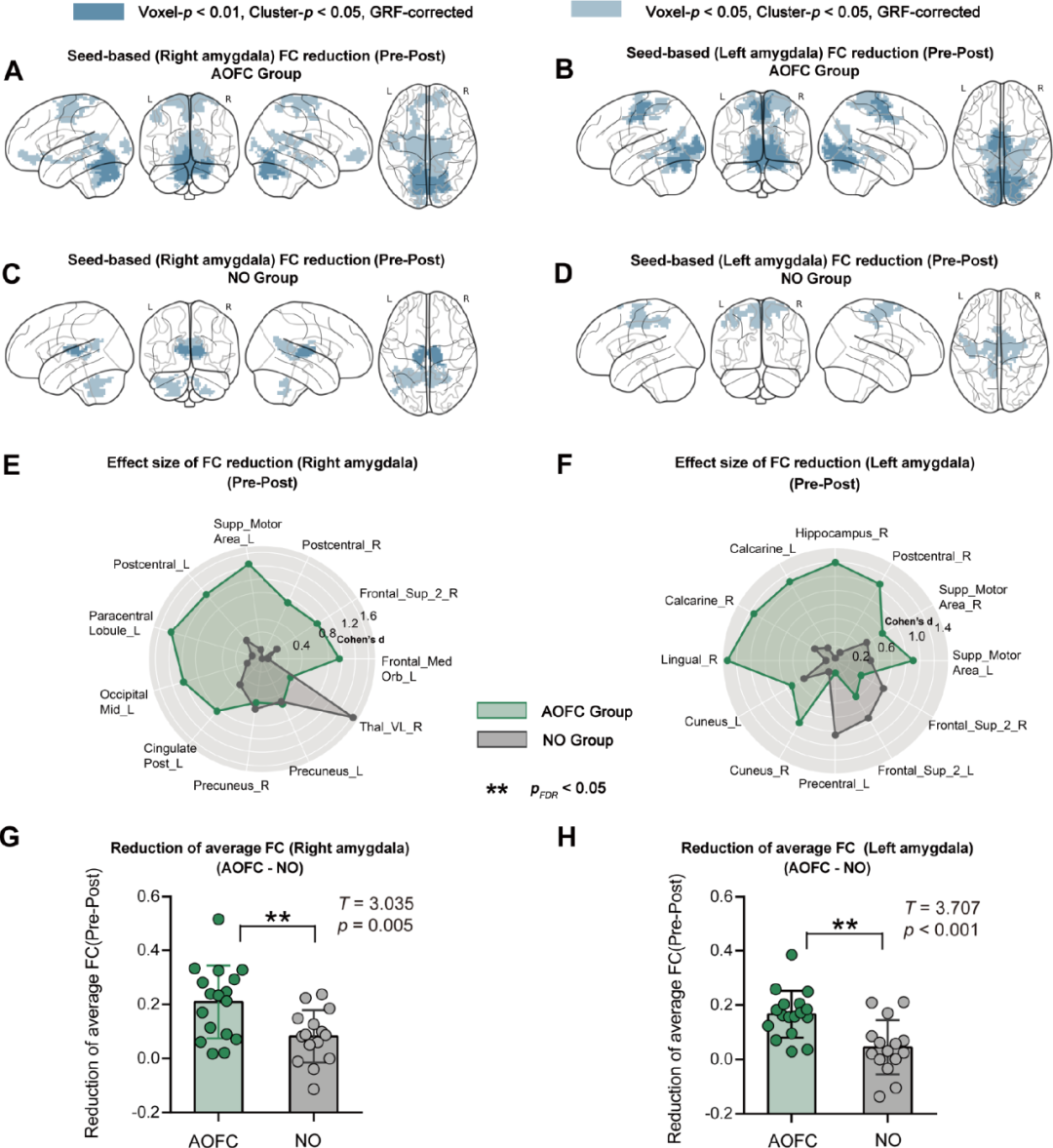
图4.(A,B)AOFC组治疗后,cTBS刺激诱导左右杏仁核种子基功能连接(FC)减少.(C,D)NO组治疗后右侧和左侧杏仁核种子FC减少.(E)AOFC组和NO组右侧杏仁核和选定皮质区域之间FC减少
六、总结与展望
本研究首次探索了个性化功能连接引导的刺激治疗在改善轻度言语障碍儿童自闭症谱系障碍(ASD)中的有效性。开发了一种基于杏仁核功能连接(AOFC)的连续theta爆发刺激(cTBS)方案,并通过随机对照试验验证了其在幼儿中的行为和临床改善效果。结果显示,AOFC引导的cTBS显著改善了ASD儿童的核心社交沟通缺陷,并导致杏仁核的形态、自发神经活动和大规模网络连接发生显著变化。相比之下,对照组未观察到类似效果。这些发现为制定针对自闭症言语障碍儿童的有效、个性化治疗策略提供了重要依据,有望解决这一群体尚未满足的重大临床需求。
未来的研究应进一步优化AOFC引导的cTBS方案,探索其在更广泛ASD患者群体中的应用潜力。同时,结合长期随访研究,深入分析治疗效果的持久性和潜在机制,以完善个性化治疗方案。此外,本研究为自闭症治疗领域提供了新的思路,强调了精准刺激靶向的重要性,有望推动更多基于脑功能连接的个性化治疗策略的发展,为改善ASD儿童及其家庭的生活质量提供有力支持。